次亜塩素酸HCLOの存在比率
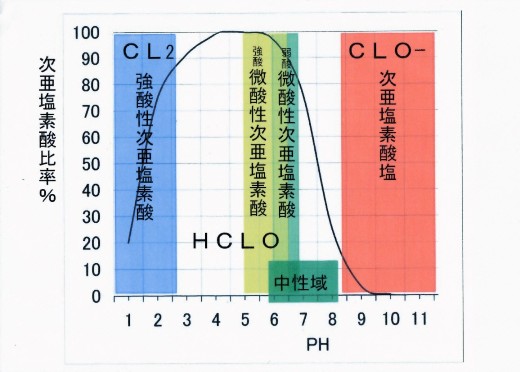
注意:上記図中、微酸性次亜塩素酸表記頭部の強酸、弱酸の文字は強酸(例:塩酸)または弱酸(例:炭酸)を中和に用いた場合に得られ易い微酸性次亜塩素酸水溶液のPH域を表すために付しています。
全有効塩素中HCLO%(酸解離定数による計算
| HCLOの性質 | 生成反応 | 生成方法 | 分解反応 |
| 安全性 | 食品添加物 | 腐食 |
| 次亜塩素酸 | |
| 化学式 | HCLO |
| 構造式 | H-O-CL |
| 性状 | 単体では存在できない。 |
| 無色透明、 無臭またはわずかに塩素臭 | |
| 水中ではPHの変化に伴い、CL2、HCLO、CLO-が一定の比率で存在する。 | |
| 水中での酸解離定数(18℃) Pka=7.53 (化学便覧より) |
次亜塩素酸HCLOの存在比率

注意:上記図中、微酸性次亜塩素酸表記頭部の強酸、弱酸の文字は強酸(例:塩酸)または弱酸(例:炭酸)を中和に用いた場合に得られ易い微酸性次亜塩素酸水溶液のPH域を表すために付しています。
全有効塩素中HCLO%(酸解離定数による計算
| PH | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 | 8.0 | 8.5 | 9.0 |
| HCLO% | 99.9 | 99.7 | 99.1 | 97.1 | 91.5 | 77.2 | 51.7 | 25.3 | 9.7 | 3.3 |
| 次亜塩素酸の生成 |
陽極での反応 1、 塩素の発生 2Cl- →Cl2+2e- 2、 発生した塩素の不均化反応 発生した塩素はただちに不均化反応を起こし、 次亜塩素酸を生成します。 Cl2+H2O→HCl+HClO 3、 酸素と水素イオンの発生 H2O→1/2O2+2H++2e- 陰極での反応 1、 水素と水酸化物イオンの発生 2H2O+2e-→H2+2OH- ここでNa+は電荷を運ぶ役目をします。 陽極で発生した水素イオンと陰極で発生した水酸化物イオンは中和してほぼ中性となります。 塩素の一部がガス化し逃散するため、およびHCLOの非解離によりややアルカリ側へ傾きます。 次亜塩素酸濃度250mg/lを生成する条件では約PH=9となります。 |
微酸性次亜塩素酸水溶液の製造手順CM6の場合(2500mg/lを生成し希釈する場合)
1、 分包された食塩1包み(20g)を2リットル容器に入れ、所定位置まで浄水を加わえ、撹拌して食塩を溶解します。
2、 容器内へ電極を差し入れ、軽く栓をして、電源をONにします。
12時間後に電気分解が完了し通電がOFFします。
3、 電気分解完了後、電極を外し、容器内の液全量を20Lタンクに移し、所定位置まで浄水を加えて20Lとします。
4、 指定の炭酸水1000〜1500mlを上記20Lタンクに入れ、撹拌します。
5、 液の一部を取り出し、所定のPHメーター、残留塩素計でPHおよび次亜塩素酸濃度を測定します。
注意事項
1、 食塩が溶けたことの確認
2、 電気分解により容器内では水素ガス、酸素ガス、塩素ガスが発生しています。
容器の栓は軽く閉めた状態として、ガスを逃がしてください。塩素ガスの臭いはほとんど感じられません。
軽く閉めることで水の流出ははぼ防げます。
3、 ガスの発生量は微量ですが、臭気、刺激等が気になる場合は換気扇や窓をあけるなどの対処を行ってください。
| 次亜塩素酸の生成方法 |
| 方式 (電解質) | 生成液 | 特徴‐長所・短所 |
| 有隔膜電解(食塩) | ・強酸性次亜塩素酸水溶液 | ・高濃度次亜塩素酸水溶液では塩素臭強い |
| 無隔膜電解(食塩) | ・アルカリ性次亜塩素酸水溶液 | ・除菌・消臭力弱い |
| 無隔膜電解(食塩)+炭酸水中和 | ・微酸性次亜塩素酸水溶液 |
・微酸性次亜塩素酸を得るもっとも簡単で安全な方法のひとつ |
| 無隔膜電解(塩酸) | ・微酸性次亜塩素酸水溶液 |
・塩酸の取扱 |
| 次亜塩素酸ソーダ+塩酸中和 | ・弱酸性次亜塩素酸水溶液 ・微酸性次亜塩素酸水溶液 |
・塩酸の取扱 ・次亜塩素酸濃度測定器、PH測定器が必要。生成の都度測定要 ・化学の知識がないと危険 |
| 次亜塩素酸ソーダ+炭酸中和 | ・微酸性次亜塩素酸水溶液 | ・次亜塩素酸濃度測定器、PH測定器が必要。生成の都度測定要 |
| 次亜塩素酸の分解 |
水中に溶解している次亜塩素酸は次のような化学反応を起こし分解して減少します。
1、自己分解反応
水溶液中でも不安定で、次のような不均化反応により塩化水素に変化しながら徐々に分解します。
特に酸性液で促進されます。また、光、温度上昇によって加速されます。
2HCLO→2HCL+O2
3HCLO→2HCL+HCLO3
次亜塩素酸ナトリウム溶液も不安定で保存中に徐々に自己分解して塩 化ナトリウムと酸素を生成します。その際、副反応として亜塩素酸ナトリウムを経て、 塩素酸ナトリウムを生成します。
2、酸化反応
有機物など酸化され易いものと触れると
HCLO→HCL+(O)
有機物などに酸素を渡して急速に分解します。
3、ハロホルム反応
アセチル基を持つ有機化合物と次亜塩素酸ナトリウムを混合し、苛性ソーダでアルカリ性を強めると、トリハロメタン(ハロホルム)が生成されます。
注意、
HCLOが分解して消失する場合、ほとんどは次の反応で塩酸を生じます。
HCLO→HCL+(O)
PH6.0以上で次亜塩素酸水溶液内に炭酸水素イオンが多く残っている場合には、発生した塩酸と炭酸水素イオンが反応し
HCL+HCO3-→CL-+H2O+CO2↑ (H2CO3 pK1=3.9(20℃)、全CO2 pK1=6.35(25℃))
となって発生した塩酸に相当する量の炭酸が逃げることにより、PHはほとんど維持されたままとなります。
HCO3-が少なく且つ、塩酸でPH5.8以下に中和された場合には、ほとんどがHCLOになってしまっておりCLO-との酸解離平衡による緩衝がないため、分解反応により生じた塩酸でPHは大きく酸性に片寄ることがあります。分解により食塩に戻るわけでは有りません。塩酸を用いた微酸性次亜塩素酸では分解後、塩酸が付着したままとなる可能性があるので噴霧などの使用には特に注意が必要です。
弱アルカリ性の次亜塩素酸ソーダ水溶液の場合は、
NaCLO→Na++CLO-→Na++CL-+(O)→NaCL+(O)
となって塩酸は生じずに食塩に戻ります。
次亜塩素酸と有機物の反応
次亜塩素酸は有機物と反応し消失します。特に糖とは速い反応を示し、自ら酸になると共に、糖を酸化し有機酸を生成します。次亜塩素酸ソーダは砂糖との反応で食塩にもどると共に有機酸を生成し全体として酸性を呈します。
体内の免疫機能の本体が次亜塩素酸であることは良く知られています。また糖尿病の人は免疫力が落ちることが知られています。血糖値が200mg/dlを超えると顕著になるそうです。現在、糖尿病と免疫力低下の関係の解明はなされていないようですが、好中球で作られた次亜塩素酸が周囲の糖で消失してしまうためと考えてみましたがどうでしょうか。(参照http://www.pariet.jp/helpful/vol58/no599/sp23.html)
実使用においてどの程度かについて
1、残留塩素濃度の経時変化
使いまわしをしているペット容器に微酸性次亜塩素酸水を入れ、直射日光の当たらない通常の明るい部屋に保存した場合、初期値250mg/lでは室温1ヵ月後約12%減、100mg/lでは室温1ヵ月後約7%減、。50mg/lでは室温2ヵ月後約10%減、初期値25mg/lでは2ヵ月後測定誤差内の減少でした。電解したままの次亜塩素酸ナトリウム水溶液初期値250mg/l、PH8.9では室温2ヵ月後約10%の減少でした。また、100mg/l 32℃では20日間後約33%の減少でした。これは一例です。条件により大きく異なります。
2、PHの経時変化
次亜塩素酸の不均化反応、酸化反応から推測されるように、PHは低下していきます。
逆浸透膜(RO膜)通過水に食塩を溶解し電解した液を塩酸でPH調整し、初期値250mg/l、PH6.0とした微酸性次亜塩素酸水のPHは7日後PH3.8まで低下しました。RO膜通過水の変わりに水道水を用いた場合にはPHの低下はほとんどなく、初期値250mg/l、PH6.3の室温2ヵ月後のPHはPH5.9でした。また、RO膜通過水に食塩を溶解し電解した液を炭酸水でPH調整し、初期値250mg/l、PH6.0とした微酸性次亜塩素酸水のPHは60日後も変化はありませんでした。次亜塩素酸250mg/lなどの比較的高濃度で保存する場合には、PH変化は水道水質に大きく左右されますので注意が必要です。
3、容器の素材について
新品容器に微酸性次亜塩素酸水を入れた場合、容器により、残留塩素濃度の低下に著しい差異が見られました。樹脂の合成時の添加物、成形性を良くするための添加物およびその量などによるものと思われます。通常は容器の使いまわしができないので、容器は十分に検討する必要があります。
4、次亜塩素酸の使用期間について
微酸性次亜塩素酸水の分解は周囲温度、光、容器成分などにより大きく変化し、初期の濃度が維持しているかどうか知ることは難しいです。長期保存による変異原性の疑われている塩素酸の生成も考慮にいれなければならず、いろいろな条件下でのデータから判断できることは保存温度は20℃以下、容器は同じものを使う、直射日光を避け、濃度は250mg/l以下、とし1ヶ月以内に使い切ることが大事です。濃度を下げ、冷暗所に保存した場合は使用期間は延びますが、基本、長期に保存しないことが重要です。
| 次亜塩素酸の安全性 |
許容濃度
次亜塩素酸の許容濃度は決められていない。
塩素の気中許容濃度は 0.5ppm : 1.5mg/m3(最大許容濃度)日本産業衛生学会(産業衛生学雑誌 Vol.44 (2002) )
管理濃度 : 0.5ppm (昭和63年労働省告示第79号 作業環境評価基準 別表(管理濃度))
| 塩素(ppm) |
|
| 0.1〜0.2 |
臭気を感ずる。 |
| 0.2〜3.5 |
臭いを感じるが耐性が生じる。 |
| 1 | かなり刺激臭が強い。 |
| 3〜6 |
目、鼻、喉に刺激、頭痛をまねく。 |
| 14〜21 |
0.5〜1時間で生命危険。 |
| 40〜60 |
短時間で生命危険。 |
| 100 | 1分間以上耐えられない。 |
| 430 | 30分以上で致命的 |
| 900 | 即死。 |
CM6で生成した微酸性次亜塩素酸水濃度50mg/l(残留塩素換算以下同じ)を加湿器で250ml/h噴霧したとき、直近周囲の気中塩素濃度は0.025ppm未満で検出できなかった。(ガステック検知管No.8LL使用)
CM6で電解生成中、付近に塩素臭はしない。電解後の炭酸水による中和時、塩素臭はしない。炭酸水そのもののPHは3.9であったが、食塩を無隔膜電解した液2L(次亜塩素酸ソーダ2500mg/l)と水道水と炭酸水2Lを加え20Lとした液はPH6.2より下がることは無かった。
北里大学などで行なった次亜塩素酸水の人畜に対する安全性、水産動植物に対する安全性では対照と比較し有意な差異が認められたケースは見当たらない。これらの結果と他の毒性試験ならびに文献等を合わせて、実使用条件における次亜塩素酸水の安全性は問題ないと考えられるとしている。*1)食品安全委員会も申請のあった2種類の次亜塩素酸につき食品への残留がないことを条件に、安全性に懸念がないと考えられるとしている。*2)
*1)電解次亜塩素酸水の概要 http://www.env.go.jp/council/10dojo/y104-02/mat10_1.pdf〜mat10_24.pdf
*2)府食第94号食品健康影響評価の結果の通知について 添加物評価書 次亜塩素酸水
塩素酸
水道法改正で水道水中の塩素酸濃度が0.4 mg/Lに強化されます。
次亜塩素酸ソーダは不均化反応により塩素酸に変化します。「塩素酸」の健康影響としては、発ガン性に関する知見は十分ではないものの、 赤血球細胞への酸化ダメージ(ヘモグロビン、血球容量、赤血球数の減少など)が
考えられています。
水道水の場合、浄水場において、6%次亜塩素酸ソーダ(製造時6〜8%)を浄水に添加しています。
6%次亜塩素酸ソーダのような高濃度では塩素酸濃度の増加も大きく、特に高温では増加が著しくなります。
参考
日本水道協会 水道用次亜塩素酸ナトリウムの 取扱い等の手引き
有効塩素の分解と塩素酸の増加との関係はあるのか
次亜塩素酸ナトリウムは時間とともに分解し、有効塩素は減少、塩素酸は増 加します。その関係は、有効塩素が1 %減少すると塩素酸が概ね3,500 mg/kg
増加するといえます。分解速度は、温度の影響が大きく、有 効塩素12 %のものが10 %に減少し、塩素酸が初期濃度よりも更に7,000mg/kg 増加するまでの期間は、温度要件だけを考慮した場合30
℃で保管すると約20 日、20 ℃では約80 日です。
また別の調査では*3)
1)注入量が多い場合、30℃で14 日ほど、20℃で40 日ほど
2)注入量が少ない場合、30℃で45 日ほど、20℃で120 日ほど
*3)府食第281号食品健康影響評価の結果の通知について 塩素酸についての関連情報
http://www.mhlw.go.jp/shingi/2007/10/dl/s1026-15i_0002.pdf〜s1026-15i_0004.pdf
| 食品添加物としての次亜塩素酸類 |
| 種類 | 定義 | 含量(有効塩素) | PH |
| 強酸性次亜塩素酸水 | 0.2%以下の塩化ナトリウム水溶液を 有隔膜電解槽(隔膜で隔てられた陽極 及び陰極により構成されたものをい う。)内で電解して、陽極側から得られ る水溶液をいう。 | 20〜60 mg/kg | 2.7 以下 |
| 弱酸性次亜塩素酸水 | 適切な濃度の塩化 ナトリウム水溶液を有隔膜電解槽内で電解して,陽極側から得られる水溶液又は陽極から得られる水 溶液に陰極から得られる水溶液を加えたものをいう。 |
10〜60 mg/kg | 2.7〜5.0 |
| 微酸性次亜塩素酸水 | 塩酸又は塩酸に塩 化ナトリウム水溶液を加えて適切な濃度に調整した水溶液を無隔膜電解槽(隔膜で隔てられていない 陽極及び陰極で構成されたものをいう。)内で電解して得られる水溶液をいう。 | 10〜80 mg/kg | 5.0〜6.5 |
また、電気分解した次亜塩素酸水溶液に食品添加物である酸を混合して用いるものは食品添加物として扱って良いとなっている。
なお、食品添加物「次亜塩素酸ナトリウム」と食品添加物である「塩酸」又は「クエン酸」等をあら かじめ混和した水溶液を販売することは、この当該水溶液中で化学反応が生じていると考えられること
から、添加物製剤には該当せず、その販売は認められない。(食安基発第0825001 号、衛化第31号 資料005、006参照)
| 腐食 |
| 材料 | 塩酸中和次亜塩素酸水50mg/l | 炭酸中和次亜塩素酸水50mg/l | 摘要 |
| SUS316 |
|
|
どちらにも錆は認められない。 |
| SUS304 |
|
|
塩酸中和したものに一部錆発生 |
| SUS430 |
|
|
塩酸中和したものに錆発生 |
| ボンデライト処理鋼鈑 |
|
|
双方錆 塩酸中和したものは腐食量が多い。 |
| その他 |
|
|
腐食しやすいものでは大差はない。 |